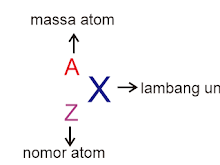
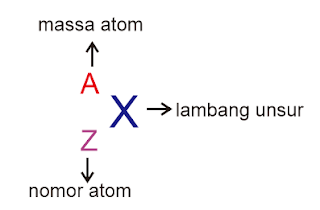
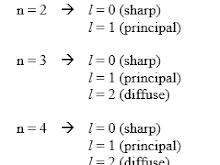Soal dan Pembahasan Sistem Periodik Unsur -
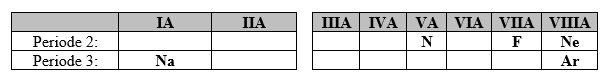
Soal Nomor 1. Di bawah ini tentukan unsur yang mempunyai keelektronegatifan terbesar ....
A. N
B. F
C. Ne
D. Na
E. Ar
Pembahasan :
Sifat keelektronegatifan unsur, dari kiri ke kanan (satu periode) cenderung bertambah dan tertinggi ada pada golongan halogen. Sementara sifat keelektronegatifan akan cenderung berkurang dari atas ke bawah (dalam satu golongan).
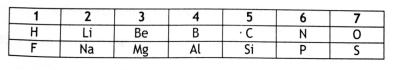
Letak unsur dalam SPU :
Jika kita perhatikan maka F (flour) mempunyai keelektronegatifan tertinggi.
Jawaban : B
Soal Nomor 2. Sifat-sifat periodik berikut dalam satu periode dari kiri ke kanan semakin besar, kecuali ....
A. sifat bukan logam
B. keelektronegatifan
C. jari-jari atom
D. afinitas elektron
E. potensial ionisasi
Pembahasan :
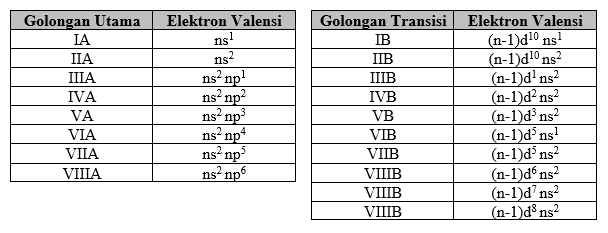
Unsur-unsur dalam SPU yang seperiode (dari kiri ke kanan) mempunyai sifat berikut :
Jari-jari atom : semakin kecil
Potensial ionisasi : semakin besar
Afinitas elektron : semakin besar
Keelektronegatifan : cenderung semakin besar
Sifat non-logam : semakin besar
Jawaban : C
Soal Nomor 3. Kalsium mempunyai nomor atom 20, maka konfigurasi yang benar untuk ion kalsium adalah ....
A. 1s2 2s2 2p6 3s2 3p6 4s2
B. 1s2 2s2 2p6 3s2 3p6 3d2
C. 1s2 2s2 2p6 3s2 3p5 4d3
D. 1s2 2s2 2p6 3s2 3p6
E. 1s2 2s2 2p6 3s2 3p6 4s2 3d2
Pembahasan :
Konfigurasi elektron kalsium (nomor atom = 20)
Ca : 1s2 2s2 2p6 3s2 3p6 4s2
Ca2+ : 1s2 2s2 2p6 3s2 3p6
Ca2+ → atom Ca kehilangan 2 elektron sehingga jumlahnya tinggal 18
Jawaban : D
Soal Nomor 4. Ion L3+ mempunyai konfigurasi [Ar] 3d3, dalam SPU, L terletak pada ....
A. Golongan IIIA periode 3
B. Golongan IIIA periode 4
C. Golongan IIIB periode 3
D. Golongan IIIB periode 4
E. Golongan VIB periode 4
Pembahasan :
Konfigurasi elektron :
L
3+ : [Ar] 3d
3 = 1s
2 2s
2 2p
6 3s
2 3p
6 3d
3 (argon = 18)
L : 1s
2 2s
2 2p
6 3s
2 3p
6 4s
1 3d
5
Pada L
3+ tiga elektron yang hilang adalah dari 4s (1 elektron) dan dari 3s (2 elektron), hal ini dikarenakan elektron meninggalkan kulit atom dari kulit yang terluar (4s)
Jawaban : E
Baca Juga : Susunan Sistem Periodik Unsur Modern
Soal Nomor 5. Penggolongan unsur di bawah ini yang
salah adalah ....
A. Kalium adalah golongan alkali
B. Kripton adalah golongan gas mulia
C. Alumunium adalah golongan boron
D. Sesium adalah golongan alkali tanah
E. Iodin adalah golongan halogen
Pembahasan :
Sesium (Cs) adalah unsur dari golongan alkali (IA)
Jawaban : D
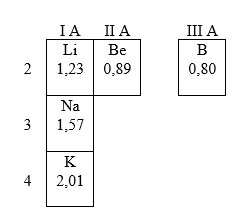
Soal Nomor 6. Jika jari-jari atom unsur Li, Na, K, Be, dan B secara acak (tidak berurutan) dalam Å adalah 2,01; 1,57; 1,23; 0,80; dan 0,89; maka jari-jari atom Li sama dengan ....
A. 2,01
B. 1,57
C. 1,23
D. 0,89
E. 0,80
Pembahasan :
Dalan sistem periodik unsur berlaku :
Untuk jari-jari atom dari atas ke bawah semakin besar karena kulit bertambah, tetapi dari kiri ke kanan semakin kecil, Urutannya :
Jawaban : C
Soal Nomor 7. Uranium dengan nomor atom 92 mempunyai konfigurasi elektron ....
A. [Rn] 5f
3 6d
1 7s
2
B. [Rn] 5f
2 6d
2 7s
2
C. [Rn] 5f
2 6d
2 7s
1
D. [Rn] 5f
1 6d
3 7s
2
E. [Rn] 5f
3 6d
2 7s
1
Pembahasan :
Radon (Rn) mempunyai nomor atom = 86, jadi supaya jumlahnya menjadi 92 di tambah 6.
Susunan sub kulit dari energi rendah ke tinggi :
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Berdasarkan aturan Aufbau maka keenam elektron terakhir akan mengisi orbital berenergi rendah ke tinggi dengan urutan 7s
2 5f
3 6d
1
Jawaban : A
Soal Nomor 8. Diketahui nomor atom Fe = 26, konfigurasi elektron ion Fe
3+ adalah ....
A. 1s
2 2s
2 2p
6 3s
2 3p
6 4s
2 3d
6
B. 1s
2 2s
2 2p
6 3s
2 3p
6 3d
5
C. 1s
2 2s
2 2p
6 3s
2 3p
6 4s
2 3d
3
D. 1s
2 2s
2 2p
6 3s
2 3p
6 4s
1 3d
4
E. 1s
2 2s
2 2p
6 3s
2 3p
6 3d
6
Pembahasan :
Fe = 1s
2 2s
2 2p
6 3s
2 3p
6 4s
2 3d
6
Fe
3+ = 3 elektron kulit terluar akan berpindah
Kulit terluar adalah 4s → 2 elektron dari 4s akan berpindah.
Kulit terluar berkutnya adalah 3d → 1 elektron dari 3d akan berpindah.
Jadi konfigurasi Fe
3+ = 1s
2 2s
2 2p
6 3s
2 3p
6 3d
5
Jawaban : B
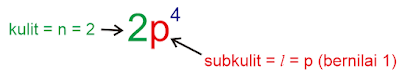
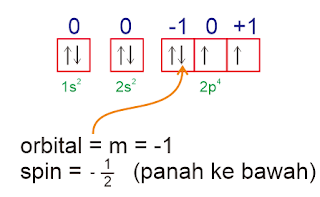
Soal Nomor 9. Unsur X bernomor atom 8, maka harga keempat bilangan kuantum elektron terakhir unsur tersebut adalah ....
A. n = 2;
l = 0; m = 0; s = -\( frac{1}{2} \)
B. n = 2;
l = 1; m = 1; s = +\( frac{1}{2} \)
C. n = 2;
l = 1; m = 0; s = -\( frac{1}{2} \)
D. n = 2;
l = 1; m = -1; s = +\( frac{1}{2} \)
E. n = 2;
l = 1; m = -1; s = -\( frac{1}{2} \)
Pembahasan :
Konfigurasi
8X = 1s
2 2s
2 2p
4 (elektron terakhir di 2p)
orbital :
Jawaban : E
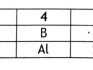
Soal Nomor 10. Di antara unsur-unsur
4A,
12B,
19C, dan
16D, yang terletak pada golongan yang sama pada SPU adalah ....
A. A dan B
B. A dan C
C. B dan C
D. B dan D
E. A dan D
Pembahasan :
Konfigurasi elektron :
4A = 1s
2 2s2
12B = 1s
2 2s
2 2p
6 3s2
19C = 1s
2 2s
2 2p
6 3s
2 3p
6
16D = 1s
2 2s
2 2p
6 3s
2 3p
4
Jawaban : A
Soal Nomor 11. Konfigurasi elektron yang benar dari unsur goongan IIA periode 3 adalah ....
A. 1s
2 2s
2 2p
5
B. 1s
2 2s
2 2p
6 3s
2
C. 1s
2 2s
2 2p
6 3s
1
D. 1s
2 2s
2 2p
6 3s
2 3p
1
E. 1s
2 2s
2 2p
6 3s
2 3p
6
Pembahasan :
Perhatikan :
A. 1s
2 2s
2 2p
5 = Golongan VII A periode 2
B. 1s
2 2s
2 2p
6 3s
2 = Golongan II A periode 3
C. 1s
2 2s
2 2p
6 3s
1 = Golongan I A periode 3
D. 1s
2 2s
2 2p
6 3s
2 3p
1 = Golongan III A periode 3
E. 1s
2 2s
2 2p
6 3s
2 3p
6 = Golongan VIII A periode 3
Jawaban : B
Soal Nomor 12. Unsur dengan keelektronegatifan tinggi mempunyai elektron keadaan dasar ....
A. 1s
2 2s
2 2p
1
B. 1s
2 2s
2 2p
6 3s
1
C. 1s
2 2s
2 2p
6 3s
2 3p
5
D. 1s
2 2s
2 2p
6 3s
2 3p
6
E. 1s
2 2s
2 2p
6 3s
2 3p
6 3d
10 4s
1
Pembahasan :
Keelektronegatifan tertinggi ada pada golongan VII A.
A. 1s
2 2s
2 2p
1 = Golongan III A periode 2
B. 1s
2 2s
2 2p
6 3s
1 = Golongan I A periode 3
C. 1s
2 2s
2 2p
6 3s
2 3p
5 = Golongan VII A periode 3
D. 1s
2 2s
2 2p
6 3s
2 3p
6 = Golongan VIII A periode 3
E. 1s
2 2s
2 2p
6 3s
2 3p
6 3d
10 4s
1 = Golongan I B periode 4
Jawaban : C
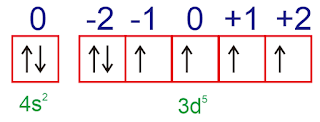
Soal Nomor 13. Konfigurasi elektron atom Fe adalah [Ar] 3d
6 4s
2. Jumlah elektron yang tidak berpasangan pada atom Fe adalah ....
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan :
Konfigurasi elektron atom Fe adalah [Ar] 3d
6 4s
2
Orbital terakhir :
Dari orbital di atas maka terlihat ada 4 elektron yang tidak berpasangan.
Jawaban : D
Soal Nomor 14. Dalam sistem periodik unsur-unsur mempunyai sifat-sifat sebagai berikut, kecuali ....
A. Dalam satu golongan mempunyai kemiripan sifat.
B. Mempunyai elektron valensi sesuai golongannya.
C. Semakin ke kanan, energi ionisasi cenderung bertambah.
D. Semakin ke kanan, jari-jari atom semakin besar.
E. Semakin ke kanan, afinitas elektron semakin besar.
Pembahasan :
Semakin ke kanan, jari-jari atom semakin kecil.
Jawaban : D
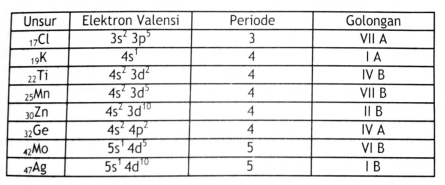
Soal Nomor 15. Unsur yang bernomor atom 24 dalam sistem periodik unsur terletak pada ....
A. Golongan I A periode 4
B. Golongan I B periode 4
C. Golongan V B periode 4
D. Golongan VI A periode 4
E. Golongan VI B periode 4
Pembahasan :
24X = 1s
2 2s
2 2p
6 3s
2 3p
6 4s
1 3d
5 (golongan VI B periode 4)
Jawaban : E
--oo0oo--