Sistem periodik unsur adalah susunan unsur-unsur berdasarkan kenaikan nomor atom dan kemiripan sifat-sifat yang dimiliki oleh masing-masing unsur.
1. Johan Wolfgang Dobereiner
Menyusun unsur-unsur dalam kelompok yang terdiri dari 3 unsur dan unsur yang di tengah (unsur ke-2) mempunyai sifat antara unsur pertama dan ketiga. Penemunya dikenal dengan "Triade Dobereiner".
Contoh :
Litium, natrium, dan kalium dimasukkan dalam satu triade;
Litium mempunyai Ar = 7
Kalium mempunyai Ar = 39
Natrium mempunyai Ar = \( \frac{(7+39)}{2} \) = 23
2. John Alexander Reina Newlands
Menyusun unsur berdasarkan kenaikan massa atom, dan menemukan pengulangan sifat terjadi pada unsur ke-8, berarti sifat unsur ke-1 sama dengan sifat unsur ke-8. Penemuannya dikenal dengan "Oktaf Newlands".Sifat hidrogen mirip dengan sifat flour, litium mirip batrium, dan seterusnya.
Baca Juga : Soal dan Pembahasan Sistem Periodik Unsur
3. Julius Lothar Meyer
- Menyusun unsur dalam satu tabel berdasar massa atom dan kesamaan sifat-sifat fisika unsur tersebut.
- Menyusun unsur dalam suatu tabel yang disebut sistem periodik dan menempatkan unsur yang bersifat sama pada satu kolom vertikal yang sama.
4. Dimitri Ivanovich Mendeleev
- Menyusun unsur dalam satu tabel berdasar massa atom, kesamaan sifat-sifat dan kesamaan sifat kimia unsur.
- Melakukan koreksi beberapa massa atom dan menukar posisi unsur dalam sistem periodik menjadi semakin baik dan tetap sesuai sifat.
- Menyediakan tempat kosong untuk beberapa unsur yang belum ditemukan.
- Unsur gas mulia dapat dimasukkan dalam sistem periodik unsur Mendeleev tanpa mengubah posisi unsur yang sudah disusun sebelumnya.
5. Henry G. Moseley
- Menemukan Sistem Periodik Unsur (SPU) Modern dan menyatakan sifat unsur merupakan sistem periodik dari nomor atomnya di mana nomor atom merupakan jumlah proton dan elektron sebuah unsur netral.
SPU Modern, seperti yang digunakan dalam mempelajari kimia saat ini tersusun atas :
a. Periode
- Baris horizontal menyatakan unsur-unsur yang dilaluinya sebagai unsur-unsur yang seperiode.
- Seperiode berarti mempunyai jumlah kulit atom sama.
Periode = Jumlah KulitContoh :
Na - Mg - Al - Si - P - S - Cl - Ar = seperiode → mempunyai jumlah kulit sama
b. Golongan
- Baris vertikal menyatakan unsur-unsur yang dilaluinya sebagai unsur-unsur yang segolongan.
- Segolongan berarti mempunyai elektron valensi (elektron pada kulit terluar) sama.
Golongan = Elektron ValensiGolongan Utama ( Golongan A) dan Golongan Transisi ( Golongan B)
Contoh :
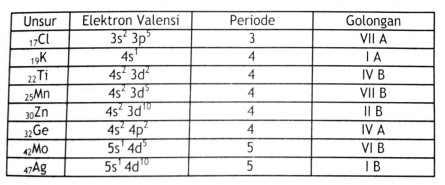
Tentukanlah letak unsur-unsur di bawah ini:
17Cl, 19K, 22Ti, 25Mn, 30Zn, 32Ge, 42Mo, 47Ag
Jawab :
Konfigurasi Elektron :
17Cl = 1s2 2s2 2p6 3s2 3p5
19K = 1s2 2s2 2p6 3s2 3p6 4s1
22Ti = 1s2 2s2 2p6 3s2 3p6 4s2 3d2
25Mn = 1s2 2s2 2p6 3s2 3p6 4s2 3d5
30Zn = 1s2 2s2 2p6 3s2 3p6 4s2 3d10
32Ge = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
42Mo = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5
47Ag = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Nama golongan pada golongan uatama adalah sebagai berikut :