Sistem periodik unsur modern yang disebut juga sistem periodik bentuk panjang, terdiri atas 7 periode dan 8 golongan. Periode 1, 2, dan 3 disebut periode pendek karena berisi sedikit unsur, sedangkan periode lainnya disebut periode panjang. Golongan terbagi atas golongan A dan golongan B. Unsur-unsur golongan A disebut golongan utama, sedangkan golongan B disebut golongan transisi. Golongan-golongan B terletak antara golongan IIA dan IIIA. Golongan B mulai terdapat pada periode 4.
Dalam sistem periodik unsur yang terbaru, golongan ditandai dengan golongan 1 sampai dengan golongan 18 secara berurutan dari kiri ke kanan. Dengan cara ini, maka unsur transisi terletak pada golongan 3 sampai dengan golongan 12.
Hidrogen ditempatkan dalam golongan IA, terutama karena mempunyai 1 elektron valensi. Akan tetapi, terdapat perbedaan sifat yang cukup nyata antara hidrogen dengan unsur golongan IA lainnya. Hidrogen tergolong nonlogam, sedangkan yang lainnya merupakan logam aktif. Dengan alasan tersebut, hidrogen kadang-kadang ditempatkan terpisah di bagian atas sistem periodik unsur.
Baca juga : Macam - Macam Koloida. Periode
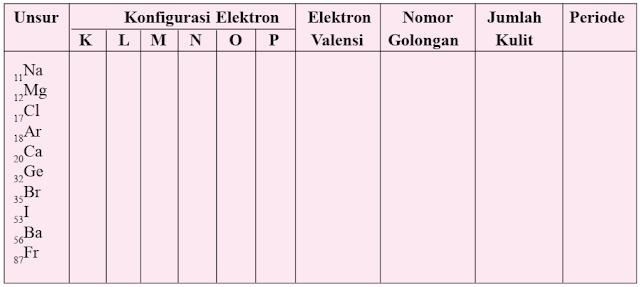
Sistem periodik unsur modern mempunyai 7 periode. Unsur-unsur yang mempunyai jumlah kulit yang sama pada konfigurasi elektronnya, terletak pada periode yang sama.
Nomor Periode = Jumlah Kulit
| Periode | Unsur |
| 1 | 2 |
| 2 | 8 |
| 3 | 8 |
| 4 | 18 |
| 5 | 18 |
| 6 | 32 |
| 7 | belum penuh |
b. Golongan
Nomor golongan = jumlah elektron valensi
| Golongan Utama (A) | Nama Golongan | Jumlah Elektron Valensi |
| IA | Alkali | 1 |
| IIA | Alkali Tanah | 2 |
| IIIA | Boron | 3 |
| IVA | Karbon | 4 |
| V4 | Nitrogen | 5 |
| VIA | Oksigen | 6 |
| VIIA | Halogen | 7 |
| VIIIA | Gas Mulia | 8 |
Baca juga : Penalaran Umum UTBK